LUYOR-3109高强度紫外催化光源促销
LUYOR-3109紫外光源采用了9颗365nm大功率led,安装有二次光学透镜,输出紫外线强度高,...
2024-08-08作者:生命科学事业部时间:2019-10-07 14:06:51浏览10110 次
在无数科学家们的努力下,蛰居于水母内的水母蛋白及绿色荧光蛋白已经被导入病毒、放线菌、酵母、植物、果蝇、线虫、小鼠、大鼠、人类细胞等几乎所有的模式生物,为无数科学研究乃至人类重大疾病的研究做出了巨大的贡献。荧光蛋白发出的生命之光,将继续照亮生命科学领域未来的道路。
1. 荧光蛋白的研究历史
2008年度诺贝尔化学奖授予美国科学家下村修(Osamu Shimomura)、马丁.查非(Martin Chalfie)和钱永键(Roger Y. Tsien),以表彰他们在生物荧光方面所做的突出贡献。下村修分离纯化了水母素和绿色荧光蛋白。马丁.查非展示了绿色荧光蛋白作为各种生物现象的亮光基因标签的科研价值。而钱永键极大地方便了绿色荧光蛋白技术的应用,解释了其机制,并发现了很多新的从红到蓝的顔色和相应的应用工具。
1962年,下村修和约翰森等在《细胞和比较生理学杂志》上报道了他们从水母(Aequorea victoria)中分离纯化了发光蛋白水母素。第二年,他们在《科学》杂志上发表了钙和水母素发光的关系的研究成果。Ridgway和Ashley利用水母素来检测钙浓度,同时水母素可以指示钙的空间分布,目前该方法仍在延用。1974年,下村修和约翰森纯化了绿色荧光蛋白(GFP)。Morin和Hastings发现水母素和GFP之间可以发生能量转移,水母素在钙刺激下发光,其能量可转移到GFP并刺激GFP发光,即生物中发生的荧光共振能量转移(FRET)现象。
1985年,普腊石和Satoshi Inouye根据水母素的蛋白质序列得到了水母素的基因序列,6年后拿到了GFP的基因序列。而GFP在其他生物体中的表达始于1994年,水母素也有相应重要的应用。水母素属于荧光酶的一种,它的发光需要底物荧光素,钙离子的存在可以促进发光反应的进行。而GFP蛋白质本身就可以发光。
GFP基因由3个外显子组成,编码形成一个由238个氨基酸残基组成的单链多肽,分子量为27 KD。GFP的荧光发射峰位于509 nm,更大激发波长为395 nm,并于470 nm处有一肩峰。GFP通常以二聚体的形式存在,形成一个内含一个α-螺旋和外面包围11个β-折叠链的β-桶状结构。这些β-折叠彼此紧密结合,和α-螺旋组成一个单独的致密结构域,没有可供扩散的配体进入的缝隙,这种坚实的结构保证了其稳定性、抗热性和抗变性剂等的特点,同时也说明了其生色基团只能自身环化,而非外源酶催化的原因。GFP的生色基团由位于第65-67位的3个氨基酸(Ser-Tyr-Gly)形成的对羟基苯咪唑啉酮构成,通过tyr66的脱质子状态和质子化状态的转换来决定荧光发射。生色基团在蓝光照射下,会吸收蓝光的部分能量,进入脱质子状态并发射出绿色荧光。
GFP具有众多优点,由于其本身可以被光激发而发光,故其应用不需加任何底物,荧光性质稳定。GFP只有27 KD,相对分子量小,并对细胞没有毒性。GFP没有种属特异性,没有假阳性干扰,灵敏度高,易于检测。GFP在生命科学领域的应用很广泛,最常见的是作为报告基因构建基因工程载体。例如将目的基因与GFP基因连接后,可通过观测融合蛋白的荧光特性来研究目的基因的表达和功能。如果将某种特定细胞利用GFP标记,就可以追踪该种细胞的生长动态过程。同时,如果将某种病原体标记上GFP,通过观察其在宿主内的运动方式和表达时间,可以研究该病原体与其宿主的关系。
钱永键于1994年开始研究GFP,他在下村修与查非的基础上进一步阐明了GFP发光的化学机制,并通过改变其氨基酸排序,造出能吸收、发出不同顔色光的荧光蛋白,包括蓝色、青色和黄色。其他研究人员又相继从珊瑚和海葵等中克隆了光谱红移的荧光蛋白基因。多色荧光蛋白技术使用科学家可以同时跟踪几种不同的生物过程,极大的促进了科学的发展。1995年,Heim等人将GFP上的Ser65点突变为Thr或Cys,荧光强度提高了4-6倍。此后的研究中用到的GFP突变体都是在此基础上通过改变若干碱基得到的。但要注意的是,GFP具有紧密的蛋白结构,可以抵抗pH变化,温度改变和变性剂的作用,而衍生的突变体多少会破坏其本身的结构,导致其对外界环境变化更加敏感。
以GFP为蓝本通过基因技术合成的突变体发射光谱涵盖了整个可见光波段,近几年针对荧光蛋白的改造工作主要集中于提高荧光蛋白的亮度,改变Stokes位移(指激发峰与发射峰之间的距离)和光谱特性,以及寻找新型光转换/光激活荧光蛋白等方面开展。下面介绍几种较为常用的绿色/红色荧光蛋白基因及发光特性。
mGFP5:将野生型GFP的ser65替换为thr,荧光强度较野生型的GFP提高了4-6倍。GFP的激发光波长与紫外线区较为接近,对光学要求较高,并且对生物有较大的毒害作用,不适宜作活细胞观察。改造后的mGFP5的激发光波长提高到488 nm,位于青色区域,有效避免了上述缺点。目前这一突变体已被EGFP替换。
EGFP:在mGFP5的基础上将Phe64替换为Leu,得到的GFP突变体命名为EGFP。EGFP的生色团在37℃的荧光得到了很大的提高,荧光强度较野生型GFP提高了35倍,并且在激发后16-24小时后仍可稳定地检测到。当然,EGFP也有相应的缺陷,对pH较为敏感,易于二聚化。EGFP目前仍然是最常用的绿色荧光蛋白。
D2EGFP:在EGFP的C端加入422-461氨基酸残基的小鼠鸟氨酸脱羧酶(MODC,mouse ornithine decarboxylase),得到一个不稳定的EGFP变体。MODC的422-461氨基酸残基区包含一个PEST序列,靶定目的蛋白降解,d2EGFP只有2小时的半衰期。
多色GFP变体:将接近GFP生色团的Thr203突变为Trp后,可以将激发光和发射光的波长均增加20 nm,再进一步改造为黄色荧光蛋白EYFP。如果将GFP生色团中的Tyr66突变为His后得到蓝色和青色荧光蛋白变体BFP/CFP。这些变体或存在光漂白现象,或荧光强度不高,或对pH变化敏感等缺陷,需要进一步的改进优化。
橙/红色荧光(560-650 nm)可以较好的与共聚焦显微镜和宽视场显微镜兼容。橙/红色荧光蛋白对于活体生物成像具有很好的应用前景,机体组织内的血红素在可见光波段有强吸收,而水与脂肪在红外波段有强吸收,在近红外光波段(650-900 nm)的吸收系数最小且自发荧光最弱。此外基于其较长的激发光波长,对细胞毒性较小,可以用于检测较深的组织。最早应用的橙色荧光蛋白是从一种热带珊瑚(Discosoma striata)中分离得到的,命名为DsRed。DsRed的激发光主峰值为558 nm,次要峰值为500 nm附近,荧光发射光波长为583 nm。DsRed成熟时间较长,易形成四聚体,阻碍了它的应用。
DsRed2:将DsRed的多肽氨基末端进行突变改造得到的荧光蛋白突变体DsRed2,减少了蛋白凝集作用,降低了细胞毒性,同时荧光蛋白的成熟时间也变短了。DsRed2依然会形成四聚体,由于成熟时间变短,在多色荧光实验中可以更好地和GFP结合使用。DsRed2相对一代DsRed应用略广泛。
DsRed-express:在DsRed2基础上进一步改造得到的,成熟时间进一步变短,荧光强度也得到了增强。DsRed的红色荧光要在表达后11小时才可以观察到,DsRed2缩短为6小时,而DsRed-express则只要1小时。遗憾的是,DsRed-express的易聚集为四聚体问题仍未得到解决。
mRFP1:代单体红色荧光蛋白mRFP1是通过改造DsRed的33个残基而来,激发光波长为584 nm,发射光波长为607 nm。同其他荧光蛋白衍生物一样,mRFP1也表现出明显的荧光发射减弱和光漂白现象。
mCherry:通过对mRFP1的发色团残基进行点突变获得新的荧光蛋白,以相应的水果名字来命名为mCherry,发射峰位于610 nm。mCherry成熟快,单体特性好,光稳定性较强,但亮度偏低。
Kaede:从石珊瑚Lobophyllia hemprichii中克隆得到的,其在紫外光照射下,发射能从绿色(518 nm)变为红色(580 nm)。Kaede是光转换蛋白中的一种,具有一个能发出绿色荧光的由三肽His-Tyr-Gly发色团,它的荧光转换是由于紧邻发光团H62上的肽键发生断裂而引起的。Kaede在斑马鱼中常用来作为研究细胞运动的标记基因,如标记原肠期的囊胚细胞研究汇聚延伸运动。Kaede易形成四聚体,限制了其在蛋白标记与超分辨成像方面的应用。
荧光蛋白的研究为生命科学提供了不可或缺的研究手段,目前在活体成像深度上仍有待进一步发展,需要不断改良优化新的亮度高的单体近红处/红色荧光蛋白分子。新特性的荧光蛋白,如光转换与光活化荧光蛋白、大strokes位移的荧光蛋白等的开发也将为光学成像技术带来新的突破,有效地提高成像的时空分辨率和灵敏度。
蛋白标记的主要目的是监测生物过程、辅助检测(例如化合物的可靠定量、蛋白质修饰的特异性检测)或者纯化标记后的蛋白及其结合对象。蛋白质的标记能够提高检测灵敏度以及简化检测工作流程。
目前有多种蛋白质标记技术来帮助我们研究感兴趣的蛋白质的丰度、位置、相互作用、翻译后修饰、功能,乃至监测活细胞中的蛋白质运输等问题。目前有多种类型的标记物和标记方式可供选择,但是针对特定的应用应当选择适合的标记策略。
no.1 代谢标记策略
代谢标记策略是一种体内标记方法,在这种方法中,细胞被“喂养”了化学标记的营养物,然后这些标记物被掺入新合成的蛋白质、核酸或代谢物中。然后,我们可以收集细胞并分离这些分子以获得细胞生物过程的全局视图。
蛋白同位素标记
原理:蛋白同位素标记是一种经典的蛋白示踪和蛋白组学定量技术,用天然同位素(轻型)或稳定同位素(重型)标记的必需氨基酸取代细胞培养基中相应氨基酸,这样细胞新合成的蛋白质可以在细胞生长期间通过掺入含有不同同位素的氨基酸进行标记。
应用举例:蛋白质组学研究方向流行的代谢标记方法是SILAC(Stable Isotope Labeling with Amino acids in Cell culture),即细胞培养中氨基酸的稳定同位素标记。结合质谱技术,SILAC通过使用重型氨基酸(例如,15N-或13C-赖氨酸)标记其中一组培养物或细胞系,而向另一组添加正常的轻型氨基酸,从而量化两种培养物或细胞系之间蛋白质丰度的差异。然后将在这两种条件下生长的细胞的裂解蛋白按细胞数或蛋白量等比例混合,经分离、纯化后进行质谱鉴定,根据一级质谱图中两个同位素型肽段的面积比较进行相对定量,得到两种条件下蛋白质丰度差异的相对评估。
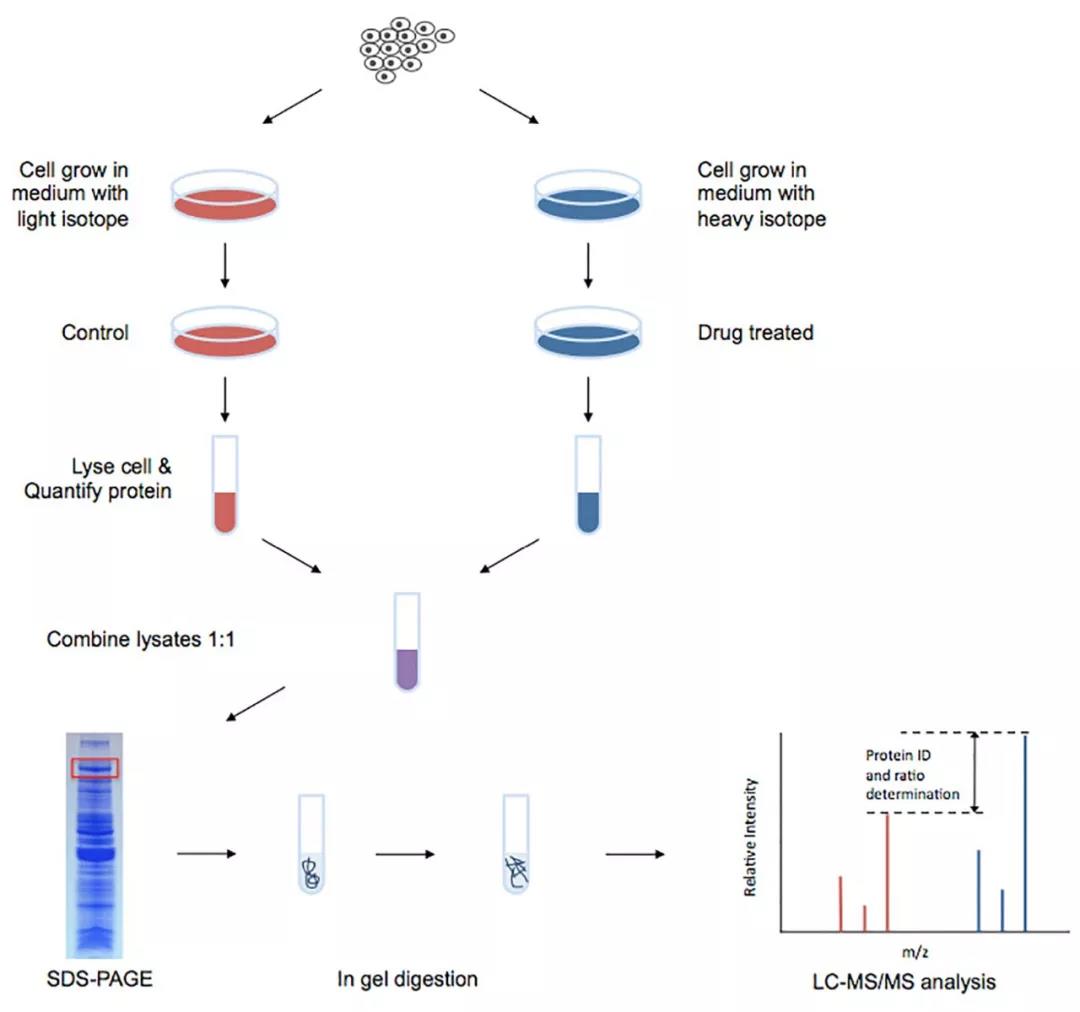
图1 SILAC的工作流程
其他蛋白质代谢标记物
原理:如果不具备质谱实验条件,那么可以使用基于生物正交反应的代谢标记方法。在生物正交系统中,细胞被“喂食”标记有一些对天然生物反应基团无反应的化学基团的分子结构单元。添加含有该基团的反应配偶体的外源性化合物引发化学反应,将标记的生物分子偶联至所需的官能团。
应用举例:用含有叠氮基团的结构单元“喂养”细胞,然后在实验后用含有磷化H基团的试剂进行处理,叠氮化物和-PH2基团通过Staudinger连接反应偶联,叠氮化物和膦基团通常不存在于生物系统中,因此这些分子是惰性的。
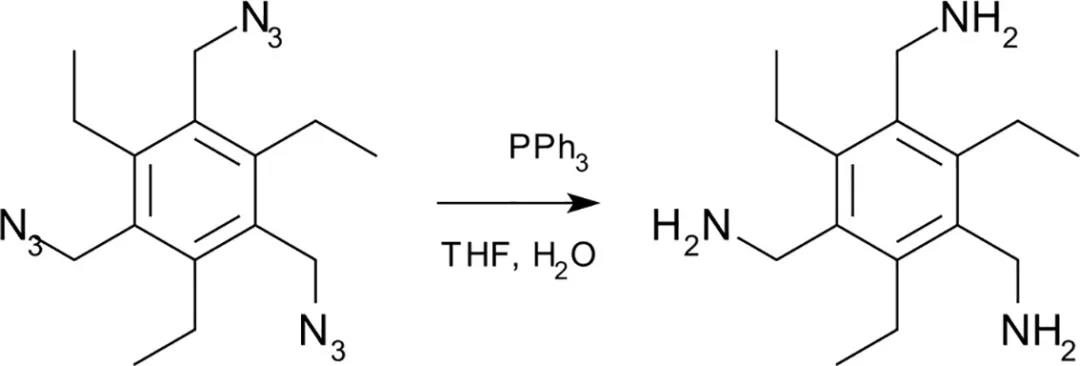
图2 Staudinger连接反应
no.2 荧光标记策略
自发荧光蛋白、小分子荧光标志物染料、纳米晶体材料(即量子点材料)、小分子蛋白质标签等等这些材料都可以作为荧光标志物,结合荧光成像检测仪器可以对目标蛋白的表达情况、细胞中的定位情况、相互作用、活性状态等指标进行研究。
荧光蛋白标签
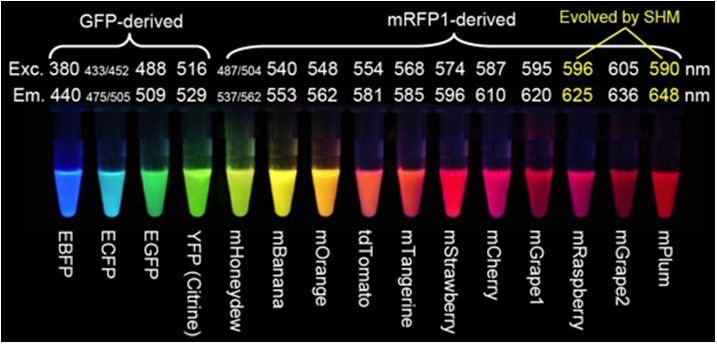
若将目的蛋白与荧光蛋白融合,则能够实现目的蛋白的细胞内观察,可用于多色标记和荧光共振能量转移(FRET)应用,用于可视化蛋白质与其他亚细胞结构的易位,研究蛋白质-蛋白质共定位,检测来自不同启动子的基因表达的开始,以及混合细胞群的分离。从早期的绿色荧光蛋白GFP发展到现在,我们已经拥有了覆盖多种光谱区域的荧光蛋白,包括绿色荧光蛋白、蓝色和蓝绿色荧光蛋白、黄色荧光蛋白、橙色荧光蛋白、红色荧光蛋白,不同光谱型的荧光蛋白在亮度、光稳定性、分子大小上有所不同。
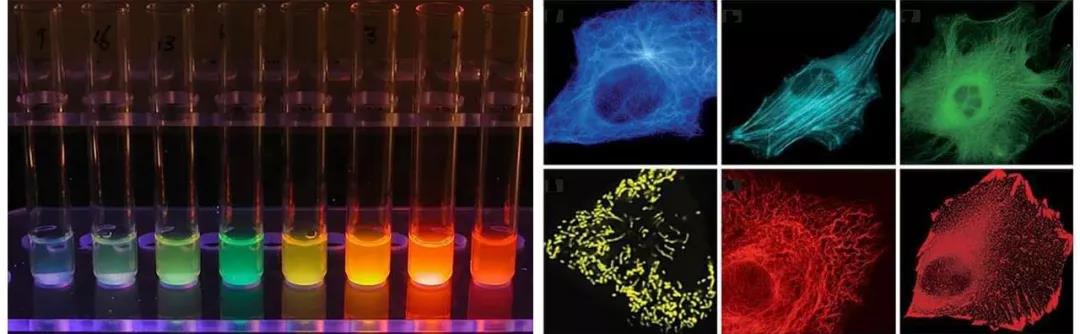
图3 荧光蛋白标签
荧光染料蛋白体外标记
荧光染料标记蛋白或多肽技术是常见的蛋白体外标记技术,除了GFP等融合表达荧光蛋白之外,目标蛋白经过荧光染料标记可以直接进行活体示踪、细胞分选等下游实验操作。
原理:荧光标记所依赖的化合物称为荧光物质。荧光物质是指具有共轭双键体系化学结构的化合物,受到紫外光或蓝紫光照射时,可激发成为激发态,当从激发态恢复基态时,发出荧光。蛋白荧光标记技术利用荧光物质共价结合在目标分子的某个基团上,利用它的荧光特性来提供被研究对象的信息。
应用和特点:活化的荧光染料,例如FITC、7-氨基-4-甲基香豆素(AMC)、罗丹明B(Rhodamine B)或Alexa Fluor染料等,可用于标记抗体或蛋白功能基团,生成分子探针并通过荧光成像进行检测。当用荧光染料化学标记特异性抗体或其他纯化的生物分子时,它们成为用于检测靶抗原或相互作用配偶体的荧光探针,应用于细胞成像、流式细胞术、蛋白质印迹和酶联免疫吸附实验(ELISA)。因为荧光标记物具有无放射物污染、操作简便等优点,使其在蛋白功能研究、药物筛选等许多研究领域的应用日趋广泛。
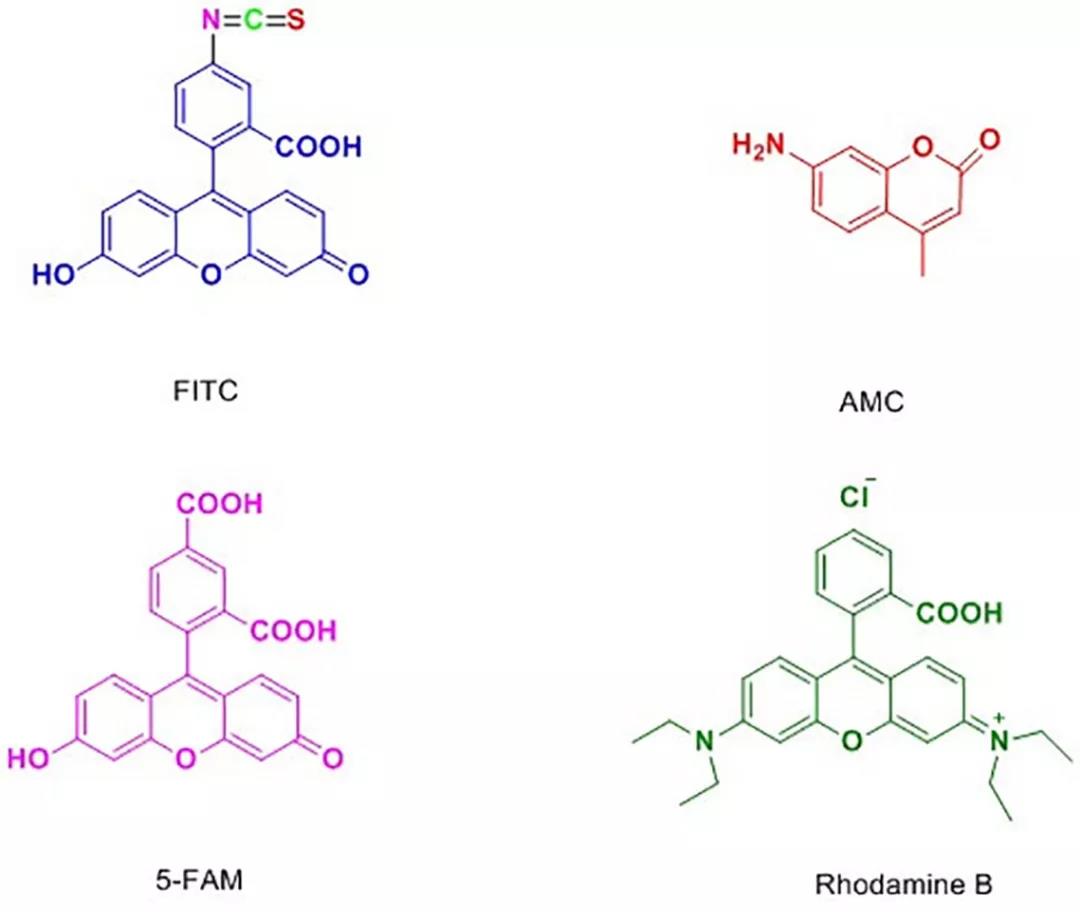
图4 四种常见的荧光染料
蛋白量子点标记
原理:量子点(Quantum Dots)是一种无机纳米结晶体,它可以根据其大小发出特定波长的荧光,它具有非常高的消光系数,其消光系数要比小分子荧光基团和荧光蛋白高出10~100倍,同时量子点的量子产率也很好。典型的量子点都含有一个CdSe或CdTe核心,外面包裹一硫化锌(ZnS)外壳。量子点的吸收波长范围覆盖从非常短的波长至略低于其发射波长的广阔范围,因此一束单波长激发光就可以让量子点达到多重发射。
应用和特点:目前研究出的水溶性量子点和油溶性量子点可以与抗体、链霉亲和素等分子进行偶联,应用于生物标记检测、高通量编码、活体成像及动态示踪等领域。不过结合了生物大分子的水溶性量子点体积较大(直径约10 nm~30 nm),从而阻碍了它通过细胞膜结构,因此只能用于经过透化处理的细胞,或者只能对胞外蛋白或可以被细胞内吞的蛋白进行研究。

图5 量子点与麦芽糖结合蛋白(MBP)大小比较。每个直径为6 nm的量子点可附着约15~20个MBP分子。
no.3 其他标记策略
生物素标记
原理:生物素(Biotin)是蛋白质检测、纯化和固定的有用标签,因为它可以高亲和力地与链霉亲和素(Avidin)和链霉亲和素(Streptavidin,SA)结合。生物素-亲和素的亲和力至少比抗原-抗体结合力高百万倍,这种相互作用是蛋白质和配体之间最强的非共价相互作用之一。另外,生物素(MW = 244.3 Da)比酶标记物小得多,因此不太影响蛋白质本身的天然功能。总之,这些特征使得生物素-亲和素策略成为许多检测和固定应用的理想选择。
生物素化蛋白质是生物素与蛋白质共价结合的产物,因为生物素化蛋白质同时具备了高亲和力、高特异性和高灵敏度的优点,所以它提高了基于免疫方法的检测、纯化蛋白质技术的效率。
应用:生物素-亲和素系统广泛用于流式细胞术、荧光成像、蛋白质印迹和ELISA检测,以增加信号输出和更高的灵敏度。亲和素或链霉亲和素的荧光缀合物用于检测生物素化的生物分子。亲和素或链霉亲和素的酶缀合物,通常用于蛋白质印迹,ELISA和原位杂交成像应用。亲和素或链霉亲和素缀合的磁珠和树脂可用于分离蛋白质、细胞和DNA,也可用于免疫分析或生物筛检。

图6 蛋白质生物素化
酶蛋白偶联物
以辣根过氧化物酶(HRP)和碱性磷脂酶(AP)为代表的酶标记物适用于与蛋白偶联并为免疫检测制备抗体偶联物。这两种标记物常被用于标记抗体后用作ELISA检测。
HRP适用于快速显色反应,ELISA检测中加入底物后在5~10 min内即可到达OD450值1.8~2.5左右,而AP适用于慢速显色反应,其显色时间约4~8 h,催化形成的黄色化合物比较稳定,比较适合酶促动力学的定量检测。
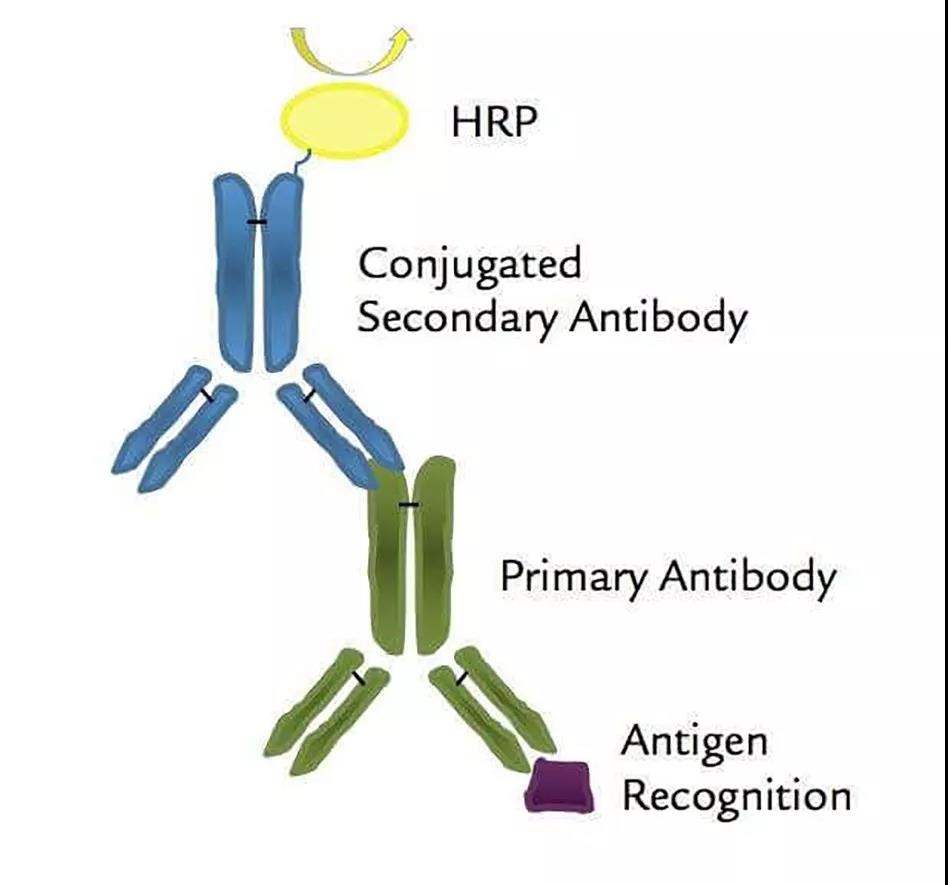
图7 HRP/抗体缀合